Ce mardi, le ministère malaisien de la Santé a annoncé l’approbation conditionnelle de l’utilisation du traitement Ronapreve. C’est un cocktail d’anticorps monodose fabriqué par Roche et Regeneron. Ce traitement figure parmi les premiers anticorps monoclonaux à usage humain autorisés pour traiter le Covid-19. Ils sont surtout destinés aux patients qui ne requièrent pas d’oxygène supplémentaire mais qui ont un risque élevé de développer une forme grave de la maladie.
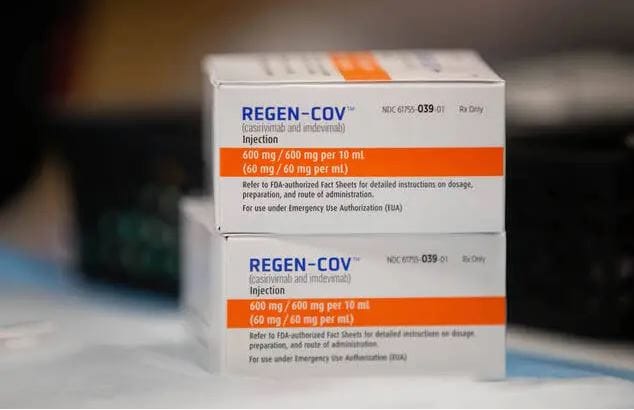
Feu vert sur l’utilisation de Ronapreve
Après la société pharmaceutique Eli Lilly avec son traitement à base d’anticorps monoclonaux, et la pilule controversée de Merck , voici Ronapreve qui est un médicament développé par les laboratoires pharmaceutiques Roche et Regeneron. Il est né de la combinaison de deux anticorps monoclonaux, dont le casirivimab et l’imdevimab.
Ce produit a fait l’objet d’une demande d’autorisation auprès de la Haute Autorité de la Santé française. Pour rappel, cette dernière s’est prononcée en faveur de son utilisation chez les personnes immunodéprimées, exposées aux formes graves de la maladie. Le Ronapreve a aussi bénéficié d’une validation d’urgence ou temporaire en Inde, dans d’autres pays d’Europe, aux Etats-Unis, au Canada et en Suisse.
En Malaisie, le ministère de la Santé vient d’approuver l’utilisation de ce cocktail d’anticorps monodose pour traiter les patients atteints du Covid-19. Notons qu’il s’agit d’une autorisation conditionnelle. Les résultats d’une étude clinique démontrent que Ronapreve permet une baisse de la charge virale en seulement 7 sept jours de traitement. Des études ont en effet révélé que les anticorps monoclonaux peuvent réduire le risque d’hospitalisations et de décès chez les patients susceptibles de développer une forme grave du Covid- 19.
Octroi d’une licence d’importation d’essais cliniques pour la pilule de Merck
Toujours dans le cadre de la lutte contre le Covid-19, le ministère malaisien de la Santé a également approuvé la demande de licence d’importation d’essais cliniques déposée par Merck&Co. Elle concerne notamment l’utilisation de sa pilule molnupravir dans le cadre d’études qui seront menées en Malaisie.
Pour rappel, la Haute Autorité de Santé française s’est prononcée le 10 décembre dans son avis, qu’elle a refusé l’accès précoce au monulpiravir en traitement curatif des formes légères et modérées des patients atteints de la covid-19. Malgré cela, le laboratoire Merck a déjà signé des accords de vente avec nombreux pays incluant la France, qui a commandé 50.000 doses de Molnupravir sans avoir attendu les autorisations de mise sur le marché.
Il est étonnant de s’apercevoir que les médicaments peu couteux aux résultats prometteurs contre les formes graves du Covid à l’image du Fluvoxamine ou l’ivermectine sont mis à l’écart. Les autorités de santé semblent préférer les traitements coûteux, aux effets secondaires peu sûrs.